
Infarct Protect
Kardiale Risiko-Früherkennung durch autonome Funktionsdiagnostik
Das autonome Nervensystem
Die Bedeutung der Regulations-Fähigkeit des autonomen Nervensystems
Gesundheit, Leistungsfähigkeit und Überleben eines Menschen hängen in enger Weise davon ab, wie gut es dem Organismus gelingt, die Körperprozesse flexibel den sich ständig verändernden Herausforderungen und Belastungen seiner materiellen und sozialen Umwelt anzupassen und das physiologische Gleichgewicht im Körper aufrecht zu erhalten. Dies erfordert nicht nur die Fähigkeit, den Körper auf die erhöhten Anforderungen akuter Belastungsphasen einzustellen, sondern gleichermaßen auch die Fähigkeit, nach Abklingen dieser Belastungsphasen den Körper wieder in einen entspannten Ruhezustand zurückkehren zu lassen, damit er vor Überlastung geschützt ist und sich regenerieren kann.
Mit dem autonomen Nervensystem (ANS) verfügt der Organismus über ein einzigartiges Regulationssystem, das in der Lage ist, diese Aufgaben weitgehend autonom, d.h. selbständig zu erfüllen, ohne dass wir uns dieser Tatsache in der Regel bewusst werden. Es gibt keine Struktur im menschlichen Organismus, dem eine bedeutendere Rolle für die Aufrechterhaltung oder Verbesserung von Fitness, Stressresistenz und Gesundheit zukommt als dem autonomen Nervensystem.
Die Beeinflussung der Körperorgane erfolgt auf zwei unterschiedlichen Wegen. Die neutrale Kontrolle erfolgt über spezifische Nervenbahnen, die zu den diversen Körperorganen verlaufen. An den sympathischen Nervenendigungen, die zu allen Körperorganen verlaufen, wird Noradrenalin als Neurotransmitter ausgeschüttet. Auf diesem Übertragungswege kann die sympathische Aktivierung selektiv und lokal auf ganz bestimmte Körperorgane beschränkt werden. Der zweite Übertragungsweg ist hormoneller Natur. Hierbei wird über sympathische Nervenbahnen die Freisetzung von Adrenalin im Nebennierenmark angeregt. Das freigesetzte Hormon gelangt auf dem Blutwege simultan zu den Körperorganen und kann auf diese Weise eine generalisierte sympathische Aktivierung auslösen, die sich auf alle Körperorgane erstreckt.
Der Sympathikus
Ein risikobehaftetes Aktivierungssystem
Der Sympathikus ist das bedeutendste Aktivierungssystem im menschlichen Körper. Es gibt praktisch keine Aktivität oder Reaktion, die nicht von sympathischen Regulationsprozessen begleitet wird. Der Sympathikus ist insbesondere dann aktiv, wenn besondere Leistungsanforderungen an den Körper gestellt werden und der Organismus darauf angewiesen ist, Energie freizusetzen und seine Leistungsreserven zu mobilisieren, um diese den anstehenden Belastungen und Herausforderungen anzupassen. Daher fördert der Sympathikus alle Körperprozesse, die dazu geeignet sind, den Körper auf hohe Leistungsanforderungen einzustellen.
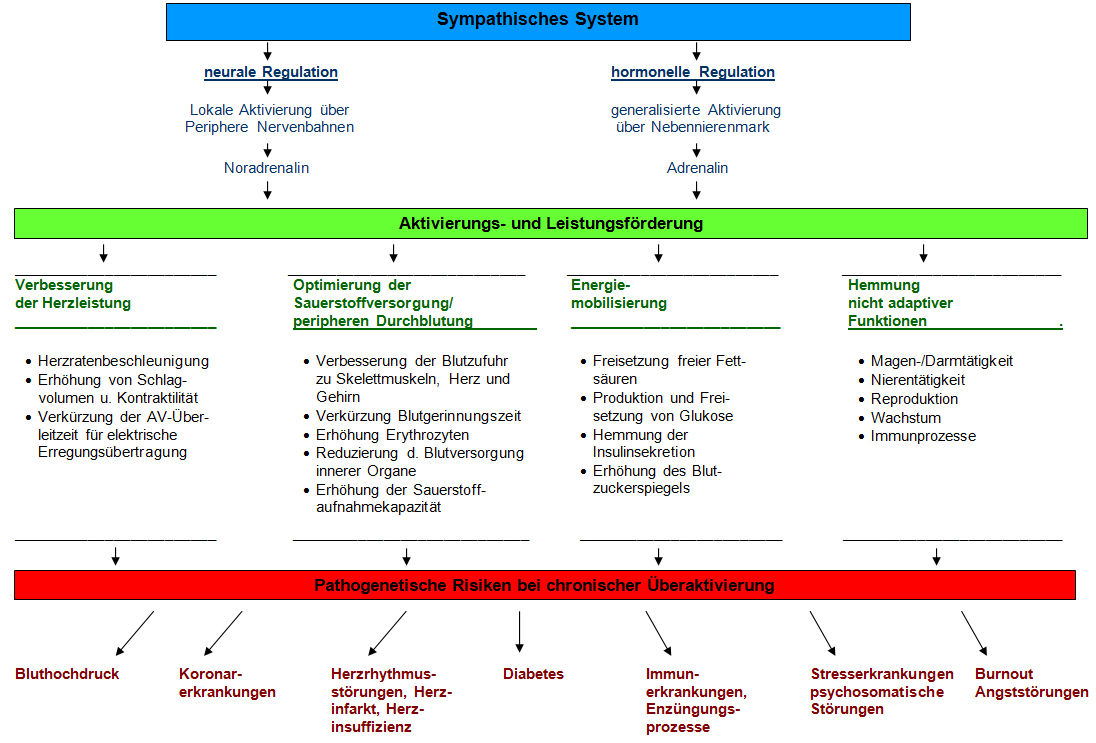
Die aktivierenden Wirkungen des sympathischen Systems sind außerordentlich vielfältig und ergänzen sich gegenseitig, wie aus der nachstehenden Darstellung ersichtlich ist. Es handelt sich dabei um ein hoch effizientes, außerordentlich hilfreiches und hochgradig koordiniertes Muster von Einzelreaktionen, die eine gemeinsame Aufgabe zu erfüllen haben, nämlich den Organismus an veränderte oder belastende Umweltkonstellationen anzupassen.
Die Wirkung dieses Reaktionsmusters verkehrt sich jedoch, wie die schematische Darstellung ebenfalls zeigt, ins Gegenteil, wenn die sympathische Aktivierung zu lange anhält oder zu einer Überaktivierung führt, was insbesondere bei psychosozialen oder Arbeitsbelastungen der Fall ist. Eine chronische sympathische Überaktivierung stellt, wenn keine ausreichende Gegenregulation erfolgt, eine beträchtliche Gefahr für die menschliche Gesundheit dar und ist für eine Vielzahl stressbedingter Erkrankungen körperlicher und psychischer Art verantwortlich.
Der Parasympathikus
Schutzmechanismus gegen stressbedingte Gesundheitsgefährdungen und Garant der körperlichen Fitness.
Dem Parasympathikus kommen zwei für die menschliche Leistungsfähigkeit und Gesundheit herausragende Rollen zu:
1. Die Schaffung von Leistungsreserven und Förderung einer ausreichenden Fitness
Für eine erfolgreiche Bewältigung von Umweltanforderungen.Während beim Sympathikus die Leistungserbringung und Energiemobilisierung im Vordergrund stehen, besteht eine zentrale Aufgabe des Parasympathikus in der Energiebereitstellung und Energiespeicherung. Damit ist es der Parasympathikus, der die Voraussetzungen dafür schafft, dass der Organismus über eine ausreichende Fitness verfügt, damit der Sympathikus bei anstehenden Belastungen auf ein optimales Energiereservoir zurückgreifen kann, um den Leistungsanforderungen gerecht zu werden. Er schafft also erst das Potential, aus dem der Sympathikus bei Bedarf schöpfen kann. Das bedeutet, dass der Parasympathikus all die Körperprozesse beschleunigt, die der Schaffung von Energiereserven dienen und die Regenerationsfähigkeit und Erholung des Körpers nach Belastungen fördern.
Zu diesen gehören insbesondere die Förderung der Nahrungsaufnahme und Verdauung, der Magensekretion, der Motilität und Peristaltik des Darmes, der Diurese der Nieren sowie die Stimulierung der Insulin- und Gallensekretion und anderer am Verdauungsprozess beteiligten Drüsen.
2. Die Schutzfunktion gegen stressbedingte Erkrankungen und Gesundheitsgefährdungen infolge chronischer sympathischer Überaktivierung
Wie in der obigen schematischen Darstellung ausgeführt, ist eine chronische sympathische Überaktivierung mit zahlreichen Erkrankungsrisiken verbunden. In der Vergangenheit ging man davon aus, dass diese Hyperaktivierung des sympathischen Systems der einzig ausschlaggebende Faktor für ein erhöhtes Erkrankungsrisiko ist. In jüngster Zeit hat sich jedoch aufgrund zahlreicher empirischer Untersuchungen die Auffassung durchgesetzt, dass die pathogenetische Relevanz der sympathischen Überaktivierung in hohem Maße von dem Aktivierungszustand des parasympathischen Systems abhängig ist und dass der Hypoaktivität des Parasympathikus eine weitaus größere Bedeutung für die Krankheitsentstehung und das Erkrankungsrisiko zukommt.
Dies bedeutet einerseits, dass dem Parasympathikus unter normalen Umständen eine absolut zentrale Rolle als Schutzmechanismus bei der Regulation gesundheitsrelevanter Körperprozesse zukommt, andererseits jedoch auch, dass Funktionsstörungen und Beeinträchtigungen der parasympathischen Kontrollmechanismen mit schwerwiegenden Folgen für die menschliche Gesundheit einhergehen.
Woher resultiert die Schutzfunktion des Parasympathikus gegenüber den Auswirkungen einer sympathischen Überaktivierung?
Schauen wir uns exemplarisch das Herz-Kreislaufsystem als häufigste Quelle von Morbidität und Mortalität an, so wird die schützende Wirkung einer effizienten parasympathischen Innervation besonders deutlich. Die wichtigsten Faktoren seien nachfolgend aufgelistet.
Verringerung von Herzarbeit und Sauerstoffbedarf des Herzens durch eine Reduzierung der Herzschlaggeschwindigkeit und eine Verringerung der Kontraktionskraft der Herzvorhöfe bei weitgehend unbeeinflusster Leistung der Herzkammer
Verringerung des Risikos für letale ventrikuläre Arrythmien durch eine Erhöhung der Erregungsschwelle, Verlangsamung der Erregungsleitung, Verlängerung der Überleitzeit für die elektrische Erregungsübertragung im Herzen (AV-Überleitzeit) und Verlängerung der Erholungszeit der Herzkammern sowie Verkürzung der risikobehafteten QT-Zeit
Direkte Hemmung der sympathischen Nervenaktivität über periphere prä- und postsynaptische Interaktionen unabhängig von den parasympathischen Einwirkungen auf den Sinusknoten und die Herzvorhöfe
Schutz vor atheromatösen Veränderungen in den Gefäßwänden der Koronararterien (Koronarsklerose) durch Inhibition des Tumor Nekrose Faktors (TNF-Alpha), dem eine pathogenetische Rolle bei der Entstehung von Entzündungsreaktionen und damit einhergehenden kardiovaskulären Erkrankungen zukommt.
Die Sinus-Rhythmus-Analyse: ein sensibles Frühwarnsystem
Kardiovaskuläre Erkrankungen sind weltweit die führende Ursache von Morbidität und Mortalität. Mit einem Anteil von fast 50 Prozent aller Todesfälle nehmen Erkrankungen des Herz-Kreislaufsystems einen führenden Platz in der Sterblichkeitsstatistik der westlichen Industrienationen ein.
In den zurückliegenden Jahren konnte eine beträchtliche Anzahl von Risikofaktoren wie Hypertonie, Diabetes, Cholesterin, Triglyzeride, C-reaktives Protein (CRP), Bewegungsmangel oder Rauchen identifiziert werden, die sowohl als Einzelfaktoren wie auch in Kombination wertvolle Hinweise auf das individuelle 10-Jahres Risiko eines akuten Koronarereignisses liefern.
Unabhängig von ihrer hervorragenden Bedeutung, die unstrittig ist, besteht allerdings ein grundlegendes Problem fast aller traditionellen Risikofaktoren darin, dass sie erst zu einem relativ späten Stadium des Entwicklungsprozesses der Krankheit ansetzen, nämlich dann, wenn bereits beträchtliche klinisch auffällige pathologische Veränderungen im Körper stattgefunden haben (Bluthochdruck, Diabetes, arterielle Veränderungen, Entzündungsprozesse usw.).
Von zentraler Wichtigkeit ist es daher, über Verfahren verfügen zu können, die in einem möglichst frühen Stadium, und zwar noch vor Auftreten traditioneller Risikofaktoren, funktionelle Veränderungen im Organismus erkennen, die als Anzeichen eines beginnenden Entwicklungsprozesses gewertet werden können, an dessen Ende klinisch relevante Erkrankungen des Herz-Kreislaufsystems stehen.
Ein Verfahren, das dieser Aufgabe gerecht werden könnte, könnte nach den einschlägigen Forschungsarbeiten der allerletzten Jahre die Analyse dre Herzschlagdynamik sein, wobei erwartungsgemäß insbesondere der Analyse der kardio-vagalen (parasympathischen) Aktivität eine herausragende Rolle zuzukommen scheint.
Risiko-Früherkennung
Vorhersage des Mortalitätsrisikos bei ursprünglich gesunden Personen
Dass Maße der HRV-Diagnostik überhaupt in der Lage sind, Vorhersagen über das Erkrankungs- oder Sterblichkeitsrisikos bei noch gesunden, d.h. zum Zeitpunkt der Erstuntersuchung noch asymptomatischen Personen zu machen, wurde in den letzten Jahren in umfangreichen mehrjährigen Längsschnittstudien belegt (vgl. u.a. Thayer et al., 2010; Thayer & Lane, 2007; Masi et al., 2007).
In der bereits 1975 durchgeführten „Men born in 1913 study“ fand man, dass 50-jährige gesunde Männer, die zum Zeitpunkt der Erstuntersuchung eine reduzierte kardiovagale Aktivität aufwiesen, nach 10 Jahren signifikant häufiger an ischämischen Herzerkrankungen gestorben waren als Männer mit einer stärker ausgeprägten parasympathischen Aktivierung.
In der 1997 durchgeführten „Zutphen Study“ wurden ursprünglich gesunde Probanden über einen Zeitraum von 5 Jahren verfolgt. Bei Männern im mittleren Alter, die bei der Erstuntersuchung eine reduzierte kardio-vagale Aktivität aufwiesen, war das Mortalitätsrisiko nach dieser Zeitspanne um das 2.1 fache erhöht. Bei älteren Männern belief sich die Erhöhung des Mortalitätsrisikos noch auf das 1.4 fache.
Im Rahmen der Framingham Heart Study (Tsuji et al., 1994) konnte man an einer Cohorte von über 700 Männern und Frauen im Durchschnittsalter von 72 Jahren nach einem Zeitraum von 4 Jahren ebenfalls ein deutlich erhöhtes generelles Mortalitätsrisiko bei den Personen mit beeinträchtigten HRV-Parametern feststellen.
Auch in der Hoorn Study (Gerritsen et al., 2001), einer prospektiven Studie an Personen aus der Allgemeinbevölkerung standen nach einem follow-up Zeitraum von 9 Jahren Maße der HRV in einem deutlichen Zusammenhang zum generellen Mortalitätsrisiko.
Schließlich untersuchten Liao et al. (2002) im Rahmen der Atherosclerosis Risk in Communities (ARIC) Study über 11 000 Personen im mittleren Lebensalter über einen Zeitraum von 8 Jahren im Hinblick auf das Mortalitätsrisiko in Abhängigkeit von verschiedenen HRV-Parametern. Sie fanden zwar die deutlichsten Zusammenhänge bei Personen, die bereits zum Zeitpunkt der Erstuntersuchung Diabetes aufwiesen. Aber auch bei asymptomatischen Patienten war das Risiko für tödliche Herzerkrankungen bei sehr niedrigen LF-Werten im Vergleich zu hohen LF-Werten um das 1.92 fache erhöht. Das Mortalitätsrisiko aufgrund sonstiger Erkrankungen war immerhin noch um das 1.33 fache erhöht.
Die erhaltenen enge Zusammenhänge zwischen veränderten HRV-Maßen und einem erhöhten Mortalitätsrisiko bei noch asymptomatischen Personen sind nicht methodenabhängig und auf Verfahren der FFT-Analyse beschränkt, sondern finden sich auch in Studien mit neueren nichtlinearen Verfahren der Analyse, der Herzschlagdynamik wie z.B. eine Studie von Stein et al. (2008) an einer Gruppe von über 1100 Personen mit einem Durchschnittsalter von 72 Jahren belegt.
Die erwähnten Untersuchungen unterstützen in ihrer Gesamtheit die Auffassung, dass HRV-Parameter, insbesondere jedoch Indikatoren der kardio-vagalen Hypoaktivierung in der Lage sind, das Mortalitätsrisiko bei ursprünglich asymptomatischen Personen vorherzusagen.
Da dieser Zusammenhang in den erwähnten Studien auch nach Kontrolle traditioneller Risikofaktoren erhalten blieb, kann man davon ausgehen, dass es sich bei der kardio-vagalen Hypoaktivierung um einen eigenständigen Risikofaktor handelt, der unabhängig von traditionellen Risikofaktoren eine Vorhersage des späteren Erkrankungsrisikos bei klinisch noch nicht auffälligen Personen handelt.
Zu berücksichtigen ist bei diesen Studien allerdings, dass sie zwar in ihrer überwiegenden Zahl an noch asymptomatischen Personen durchgeführt wurden. Da die Mehrzahl dieser Untersuchungen jedoch aus naheliegenden methodischen Gründen an älteren Individuen aus der Allgemeinbevölkerung durchgeführt wurde, gehören diese bereits aufgrund ihres höheren Lebensalters einer Risikopopulation an. Was zurzeit noch fehlt, sind entsprechende Langzeituntersuchungen an noch jungen, gesunden Personen.
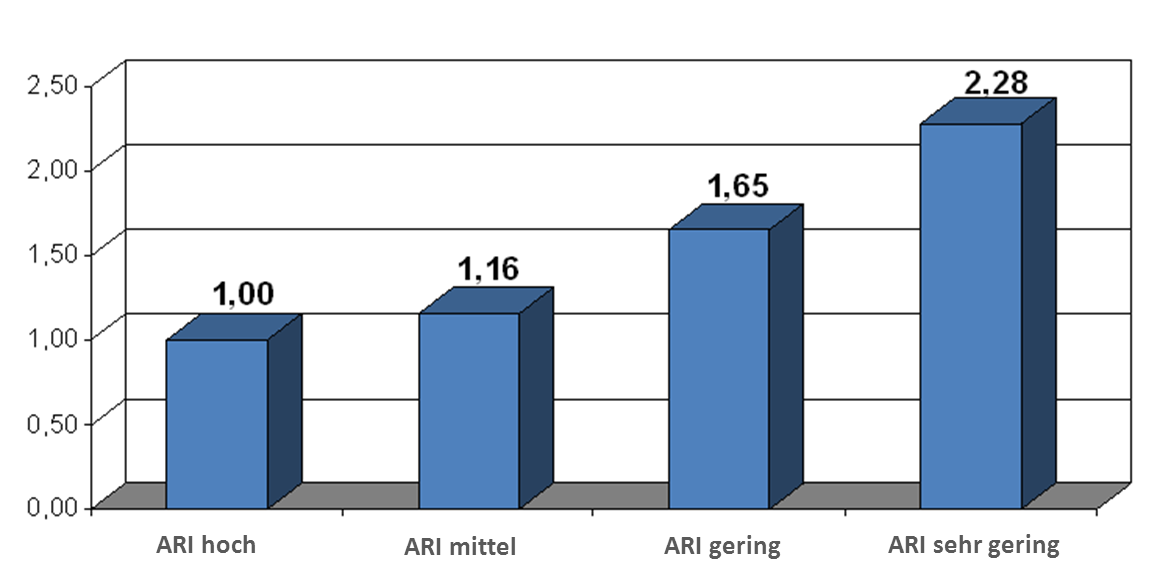
Die Graphik zeigt das steigende Mortalitäts-Risiko in Abhängigkeit des autonomen Regulations-Index (ARI)
Risikofaktor Sinus-Rhythmus (Kardio-vagale Hypoaktivierung)
Die herausragende Bedeutung der kardio-vagalen Hypoaktivierung als Risikomarker und Frühindikator beginnender kardiovaskulärer Erkrankungsprozesse wird noch durch die sich immer deutlicher abzeichnende Erkenntnis gestützt, dass alle zurzeit bekannten traditionellen Risikofaktoren kardiovaskulärer Erkrankungen mit einer kardio-vagalen Hypoaktivierung assoziiert sind.
Noch bedeutsamer ist allerdings die Tatsache, dass die kardio-vagale Hypoaktivierung auch zeitlich dem Auftreten traditioneller medizinischer Risikofaktoren vorauszugehen scheint, so dass sie bereits vor dem Auftreten klinischer Symptome oder traditioneller Risikofaktoren auf funktionelle Veränderungen in den zentralen Regulationsmechanismen des Körpers hinweist, die ursächlich an der Entstehung kardiovaskulärer Erkrankungen und deren Vorläufer beteiligt sind (Thayer et al., 2010; Thayer & Lane, 2007; Masi et al., 2007).
-
Hypertonie
Die deutlichsten Zusammenhänge liegen zurzeit im Hinblick auf die Hypertonie vor, dem vermutlich bedeutsamsten einzelnen traditionellen Risikofaktor kardiovaskulärer Erkrankungen.
Zunächst haben Querschnittsanalysen an umfangreichen Stichproben eindeutige Hinweise dafür erbracht, dass der kardio-vagale Tonus bei Personen mit klinisch relevantem Bluthochdruck generell bedeutsam geringer ist als bei Personen, die nach derzeitigen Kriterien einen normalen Blutdruck aufweisen, und zwar auch nach Kontrolle relevanter Kovariate. So fanden z.B. im Rahmen der ARIC-Studie Liao et al. (1996) an 2061 Personen und Schröder et al. (2003) an über 11 000 Personen eine signifikant verringerte kardio-vagale Aktivierung bei Hypertonikern im Vergleich zu Normotensiven, und zwar auch nach Berücksichtigung von Variablen wie Alter, Geschlecht, Rauchen, Diabetes, BMI und Erziehungshintergrund.
Interessanterweise existieren für die Hypertonie darüber hinaus auch einige umfangreiche prospektive Studien (Längsschnittanalysen), die sich mit der Analyse des zeitlichen Zusammenhangs von kardio-vagaler Hypoaktivierung und Hypertonie befasst haben.
So haben Liao et al. (1996) in dem prospektiven Teil der oben bereits erwähnten ARIC-Studie Personen über einen follow-up Zeitraum von 3 Jahren verfolgt, die bei der Erstmessung keine klinisch relevante Hypertonie aufwiesen, sich jedoch in der Höhe ihrer kardiovagalen Aktivierung bedeutsam unterschieden. Sie fanden, dass der bei der Erstmessung erhobene kardio-vagale Tonus in einem inversen Zusammenhang zur Entwicklung einer Hypertonie stand. Nach Berücksichtigung von Alter, Geschlecht, Rauchen, Diabetes und Erziehungshintergrund hatten Personen mit einem niedrigen kardio-vagalen Tonus (unterstes Quartil der Verteilung) ein 2.4 fach höheres Risiko für die Ausbildung von Bluthochdruck als Personen mit einem hohen kardio-vagalen Tonus (oberstes Quartil).
Diese Befunde wurden auch in einer jüngeren, noch wesentlich umfangreicheren Auswertung der ARIC-Studie (Schröder et al., 2003) bestätigt, bei der 7099 Personen, die bei der Erstmessung keine Hypertonie aufwiesen, über einen Zeitraum von 9 Jahren verfolgt wurden. Auch hierbei zeigte sich, dass Personen mit einem niedrigen kardio-vagalen Tonus (unterstes Quartil) ein signifikant höheres Risiko für die Ausbildung von Hypertonie aufwiesen als Personen mit einem hohen kardio-vagalen Tonus (oberstes Quartil).
Daher können wir davon ausgehen, dass ein Rückgang des kardio-vagalen Tonus offensichtlich der Entwicklung des zentralen Risikofaktors Hypertonie zeitlich vorausgeht und damit zur Entstehung von klinisch relevantem Bluthochdruck unmittelbar beiträgt.
-
Diabetes
Auch im Hinblick auf den traditionellen Risikofaktor Diabetes konnte ein enger Zusammenhang zur kardio-vagalen Hypoaktivierung nachgewiesen werden.
Signifikante Zusammenhänge zwischen einem verringerten kardio-vagalen Tonus und einem erhöhten Risiko für klinisch relevante Diabetes fanden sich u.a. in der ARIC-Studie (z.B. Liao et al., 1995) und in der Framingham Heart Study (Singh et al., 2000) an jeweils knapp 2000 Personen.
Außerdem fanden sich in diesen Studien wie auch in anderen groß angelegten Studien (Koskinen et al., 2004; Lindmark et al., 2003) signifikante inverse Zusammenhänge zwischen einer verringerten kardio-vagalen Aktivierung und dem Nüchtern-Glukosespiegel sowie dem Nüchtern-Serum Insulin, und zwar bemerkenswerterweise auch bei Nicht-Diabetikern. So war das parasympathische Aktivierungsniveau bei Nicht-Diabetikern mit einem hohen Serum-Insulin deutlich niedriger als bei solchen mit einem niedrigen Serum-Insulin.
Schließlich fanden sich auch in Untersuchungen an jüngeren Erwachsenen im Alter zwischen 24 und 39 Jahren (Koskinen et al., 2004) und an Verwandten 1. Grades von Diabetikern (Lindmark et al., 2003) Zusammenhänge zwischen einer verringerten kardio-vagalen Aktivierung und einer verringerten Insulinsensitivität bzw. einer erhöhten Insulinresistenz. Es drängt sich daher die Vermutung auf, dass eine kardio-vagale Hypoaktivierung zur Entwicklung einer Insulinresistenz und von Diabetes beiträgt.
-
Atheromatöse Entzündungsprozesse
Von besonderer Bedeutung dürfte angesichts der Tatsache, dass Entzündungsprozesse offensichtlich eine zentrale Rolle bei der Entstehung von kardiovaskulären Erkrankungen spielen, auch ein sich abzeichnender Zusammenhang zwischen einer kardio-vagalen Hypoaktivierung und einem erhöhten Risiko für klinisch relevante Entzündungsprozesse spielen. Nachdem, wie oben bereits angemerkt wurde, dem vagalen System durch die Inhibierung des Tumor Nekrose Faktors (TNF-Alpha) eine zentrale Rolle bei der Kontrolle von Entzündungsprozessen zukommt, ist es kaum überraschend, dass in jüngsten Studien an unterschiedlichen Stichproben aus der Allgemeinbevölkerung und klinischen Populationen auch nach Berücksichtigung verschiedenster Kovariate eindeutige Hinweise dafür gefunden wurden, dass eine kardio-vagale Hypoaktivierung einen engen Zusammenhang zu verschiedensten Entzündungsparametern aufweist wie Interleukin-6, C-reaktives Protein, Anzahl weißer Blutkörperchen usw. (Janszky et al., 2004; S ajadich et al., 2004; Thayer & Fischer, 2005; Haensel et al., 2008; von Känel et al., 2008; Lampert et al., 2008).
-
Familiäre Belastung
Auch familiäre Belastungen durch Hypertonie (Piccirillo et al., 2000; Mavrer et al., 2004) sowie durch Diabetes (De Angelis et al., 2001; Lindmark et al., 2003) stehen in einem direkten Zusammenhang zu einem verringerten kardio-vagalen Tonus.
-
Lebensstilfaktoren
Schließlich weisen auch Lebensstil bezogene Risikofaktoren wie Rauchen (Hayano et al., 1990; Fifer et al., 2009.), Übergewicht (Karason et al., 1999; Riva et al., 2001) oder Bewegungsmangel (Rennie et al., 2003) einen eindeutigen Zusammenhang zu einem verringerten kardio-vagalen Aktivierungsniveau auf.
-
Alter
Höheres Lebensalter ist ein bedeutsamer Risikofaktor für ein weites Spektrum von Krankheiten. Insofern ist es nicht überraschen, dass es parallel zum Anstieg des Lebensalters zu einem kontinuierlichen Rückgang des kardio-vagalen Aktivierungsniveaus kommt. Dieser Prozess setzt bereits zu einem überraschend frühen Zeitpunkt, und zwar etwa ab 30 Jahren ein und erstreckt sich bis ins höchste Lebensalter (De Meersman & Stein, 2007; Wittling et al., 2008).
Verlaufsprognose nach Herzerkrankung
Im Rahmen der sekundären Prävention hat sich im Laufe der letzten Jahre eine größere Anzahl von follow-up Studien mit der Erforschung der prognostischen Bedeutung der HRV, insbesondere aber von SDRR und Maßen der kardio-vagalen Hypoaktivierung für die Vorhersage des Krankheitsverlaufs bei klinisch bereits auffälligen Hochrisikopatienten beschäftigt, vor allem bei Postinfarkt-Patienten und Patienten mit Herzinsuffizienz. Die Untersuchungen belegen in großer Übereinstimmung, dass HRV-Parameter, unabhängig davon, ob sie in 5-Minuten oder 24-Stunden Messungen gewonnen wurden, einen eigenständigen prognostischen Wert zur Vorhersage des Krankheitsverlaufs haben, dessen Bedeutung unabhängig von traditionellen Risikofaktoren wie der linksventrilulären Auswurfleistung oder ventrikulären Rhythmusstörungen ist. In Kombination mit diesen sind sie darüber hinaus in der Lage, die Vorhersagegenauigkeit des Mortalitätsrisikos deutlich zu verbessern.
Den ersten klinisch bedeutsamen Beleg für die enorme Bedeutung der Sinus-Rhythmus-Analyse als Prädiktor des Mortalitätsrisikos nach Herzinfarkt lieferte das „Multicenter Post-Infarction Project“ mit der Studie von Kleiger et al. (1987) an über 800 Postinfarkt-Patienten. Die Sinus-Rhythmus-Dynamik der Patienten wurden innerhalb der ersten beiden Wochen nach dem Infarktereignis mittels einer 24-Stunden Messung von SDRR bestimmt. Anschließend wurden die Patienten über einen Zeitraum von bis zu 4 Jahren beobachtet. Von den Patienten, die eine gut ausgeprägte Sinus-Rhythmus-Dynamik aufwiesen (SDRR > 100ms), starben im Beobachtungszeitraum 9%. Bei den Patienten mit einer durchschnittlich ausgeprägten Sinus-Rhythmus-Dynamik (SDRR 50 – 100ms) betrug die Mortalitätsrate 13.8%. Bei den Patienten mit einer ungenügend ausgeprägten Sinus-Rhythmus-Dynamik (SDRR < 50ms) kam es zu einem dramatischen Anstieg der Mortalitätsrate auf 34.4%, was einem Anstieg um das 5.3-fache entspricht.
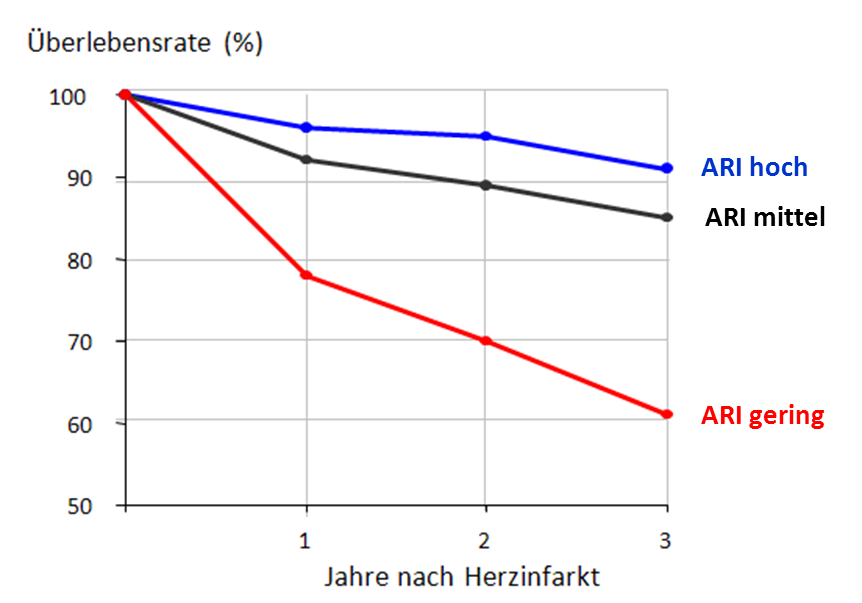
ARI = Autonomer Regulations-Index (aus der Analyse der Sinus-Rhytmus-Dynamik wird die Regulations-Fähigkeit des Organismus ermittelt und als Index zwischen den Werten 0 und 100 angegeben)
In zahlreichen neueren Untersuchungen an Postinfarkt-Patienten sowie an Patienten mit chronischer Herzinsuffizient konnten diese Befunde regelmäßig bestätigt werden (vgl. z.B. Reviews von Routledge et al. 2010 und Buccelletti et al., 2009)).
So untersuchten z.B. La Rovere et al. (1998) im Rahmen einer internationalen prospektiven Multicenterstudie 1284 Patienten nach einem kürzlich erlittenen Herzinfarkt (< 28 Tage) mittels einer 24-Stunden SRA-Messung und einer Messung der Baroreflex-Sensitivität. Während der nachfolgenden 21 Monate starben 44 Patienten an Herzversagen, während 5 Patienten einen nichtfatalen Herzstillstand erlitten. Das Mortalitätsrisiko erhöhte sich um das 3.2-fache bei Patienten mit geringen Sinus-Rhythmusdynamik-Werten (SDRR < 70ms) und um das 2.8-fache bei Patienten mit niedriger Baroreflex-Sensitivität (< 3ms per mmHg). Wiesen Patienten niedrige Werte in beiden autonomen Maßen auf, erhöhte sich das Mortalitätsrisiko weiter. Die 2-Jahres Mortalität belief sich auf 17%, wenn die Patienten unter den cut-offs lagen, aber nur 2% bei gut erhaltenen autonomen Indikatoren. Wurde der SRA-Parameter SDRR mit einem traditionellen Risikofaktor (linksventrikuläre Auswurfleistung) kombiniert, so erhöhte sich das relative Mortalitätsrisiko auf das 6.7-fache. Ähnliche Befunde ergaben sich auch in anderen Untersuchungen an Postinfarkt-Patienten, so z.B. in der umfassenden Studie von Camm et al. (2004) an über 3700 Patienten, sowie in Untersuchungen an Patienten mit Herzinsuffizienz (z.B. Nolan et al., 1998).
Links zum Thema
Schnelltest zur Berechnung des individuellen Herz-Risikos:
© 2017 by Infarct Protect AG. All rights reserved.